Second Scientific Lecture-Course:
Warmth Course
GA 321
6 March 1920, Stuttgart
Lecture VI
My dear friends,
We will today first examine a phenomenon that comes in the region where heat, pressure and the expansion of bodies are related. You will see that by a simultaneous examination of the things we experience in this field the way will open to an understanding of what heat really is. First we will turn our attention to what is revealed here in these three tubes. In the first one on the right, we have mercury in a barometer tube and on top of it is some water. Water placed in such a manner in this space evaporates. The water is in a vacuum, as we call it, in empty space, and it can be stated that the water evaporated. The small amount of water in the tube gives off vapor. We can determine that it evaporates by testing for the presence of water vapor in the space above the mercury. When you compare the height of the mercury column in this tube with the height here where the mercury is under the normal atmospheric pressure, and where there is no water vapor over the mercury, you will see that the level is lower in the tube containing water (Fig. 1a, 1b). Naturally, the mercury can lower only if there is a pressure on top of the column. For in the barometer tube, there is no pressure on the top of the column. There is only empty space and the mercury column balances the atmospheric pressure and is equal to if. Here it is forced down. When we measure we find the value of this difference in height. And the amount of the depression is brought about by the pressure of the water vapor, by the vapor tension as it is called. That is, the mercury volume is forced down here. We see therefore, that vapor always presses on the confining walls. Moreover, a definite pressure corresponds to a definite temperature. We can demonstrate this by warming the upper part of the tube. You can see that when the temperature is raised, the mercury column sinks, due to the increased pressure of the vapor. Thus we see that the vapor increases its pressure on the wall more and more the higher its temperature. You can observe the mercury fall and see how the vapor tension increases with the temperature. The volume occupied by the vapor is correspondingly increased.
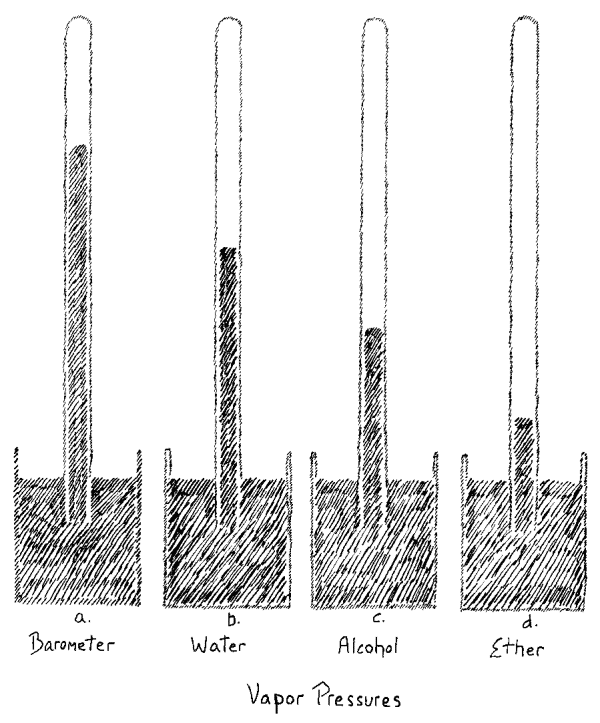

In the second tube we have alcohol over the column of mercury (Fig. 1c). Again you can see the liquid alcohol occupying definite volume. It evaporates and consequently the column is less in height than the barometric column on the left. If I measure, I find that it is shorter than the column which is under the pressure of the water vapor. We must wait until the water vapor returns to the same temperature as it was before being heated. Then we will find the vapor tension dependent on the substance we are using. The tension is greater in the case of alcohol than in the case of water. Here again, I can make the same experiment with heat. You will see that the pressure becomes considerably greater when we raise the temperature. When we cool the vapor to the same point at which it was at first, the mercury column rises, since with smaller vapor tension there is less pressure.
In the third tube we have ether under the same conditions as in the other tubes. It also evaporated (Fig. 1d). You observe the column here is very low. From this you can see that ether evaporating under the same conditions as water shows a widely different pressure. Not only is the pressure exerted by a vapor dependent on the temperature, but on the material as well. Here you see the effect of increased temperature, but on the material as well. Here you see the effect of increased temperature, shown by lowering of the column (tube warmed slightly) due to the rise in vapor pressure. We can again in this case, verify the phenomena and thus round out our survey and lead to the result we wish to attain.
Now there is an occurrence that I wish especially to call to your attention. You know from the foregoing observation and also from elementary physics that solids may be changed to liquids and liquids to solids if we raise the temperature above the melting point and lower it below the melting point. Now, when a fluid body is solidified by being brought under the melting point, it remains a solid body. The noteworthy fact, however, is that if we impose on this solid body a sufficiently great pressure, it will melt at a temperature below its melting point under ordinary pressure.
Thus it can become liquid at a lower temperature than the one at which it solidified. You know that water changed to ice at 0°C. and it must be a solid at all temperatures under 0°C. We will now carry out an experiment on this ice which will show you that we can make it a liquid without raising the temperature. Ordinarily, we would have to raise the temperature to do this. In this case we will not raise the temperature but simply exert a strong pressure on the ice. This we can do by hanging a weight over the ice by means of a thin wire. The ice melts under the wire, and the wire cuts its way through the ice. Now, you would expect this block of ice to fall apart into two pieces since it is being cut through the middle. It we could make it work faster you would see the results of this experiment. (Note: the cutting of the block proceeded so slowly that the result described in the following did not occur until several hours after the end of the lecture.) If you will now step up here and examine the block of ice, you will find there is no reason to fear that the two halves will crash down when the wire has cut its way through. For the solid ice grows together at once above the cut; so that the wire goes through the block, the weight falls off and the block remains whole. This shows that fluidity is brought about under the pressure of the wire, but as soon as the fluid is released from the spot where the pressure is exerted, it solidifies and the block of ice becomes whole again.
At the temperature of ice, the state of fluidity only establishes itself under increased pressure. Thus a solid can be melted at a temperature under its melting point, but the pressure must be maintained if it is to stay melted. As soon as the pressure is released it reverts to the solid state. This is what you would see if you could wait here an hour or so.
A third thing I wish to present to you and which will furnish support for our observations is the following: To illustrate it we can take any bodies making an alloy, that is, mixing without forming a chemical compound; the principle holds for all of them. In this tube we have bismuth that melts at 269°C. and here we have tin, melting at 232°C. Thus we have three bodies all of which have melting points over 200°C. Now we will first melt these three, bringing them into the fluid condition in order to form an alloy. They will mix without combining chemically. (Note: the three metals were melted and poured together.)
Now, you would naturally reason as follows: Since each of these metals has a melting point above 200°C. it would remain solid in boiling water, for water has a melting point of 0°C. and a boiling point of 100°C. Therefore these three metals could not melt in boiling water. Let us however carry out the experiment of bringing the allow, the mixture of the three, into water, just at the boiling point of 100°C. In this way we can see how it acts. We hold the thermometer here in the fluid metallic mixture and read a temperature of 94°C. This shows that although no single metal was fluid at this temperature, the alloy is fluid. We can state the fact thus: when metals are mixed, the fact is brought out that the melting point of the mixture is lower than the melting point of any of its constituents. Thus you can see how bodies mutually influence each other. From this particular fact we can derive an important principle for our view of the nature of heat phenomena.
Here we have the still fluid alloy in boiling water that is at 100°C., and now we let the water cool, observing the temperature meanwhile. The alloy finally solidifies. By measuring the temperature of the water at this point, we have the melting point of the alloy and can show that this melting point is lower than the melting point of any of the single metals.
We have now added this phenomenon to the others to extend the foundations of our view. Let us continue by tying in the things we considered yesterday in regard to the distinction between the solid, the fluid and the gaseous or vapor states. You know that solid bodies such as most metals and other mineral bodies, occur not in an indefinite form, but in very definite shapes that we call crystals. We can say: Under ordinary circumstances as they exist on the earth, solids occur in very definite shapes or crystal forms. This naturally leads us to turn our attention to these forms, and to try to puzzle out how these crystals originate. What forces lie at the foundation of crystal formation? In order to gain some insight into these matters, it will be necessary for us to consider the forces on and around the earth in their entirety as they are related to solids.
You know that when we hold a solid in our hand and let go of it, it falls to the earth. In physics this is usually explained as follows: The earth attracts solid bodies, exerts a force on them; under the influence of this force—the gravitational force—the body falls to the earth.
When we have a fluid and cool it so that it solidifies, if forms definite crystals.
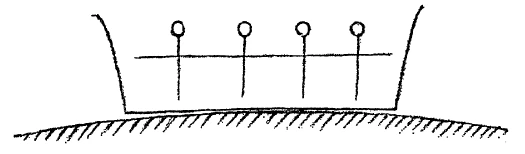
The question is now, that is the relation between the force acting on all solids—gravitation—to these forces tending to produce crystal form which must be present and active to a certain extent? You might easily think that gravity as such, through whose agency a body falls to the earth (we may at this stage speak of the force of gravity) you might think that this gravitational force had nothing to do with the building of crystal form. For gravity affects all crystals. No matter what form an object may have, it is subject to gravity. We find when we have a number of solids in a row and take way the support, that they all fall to earth in parallel lines. This fall may be represented in somewhat the following way: (Fig. 3).
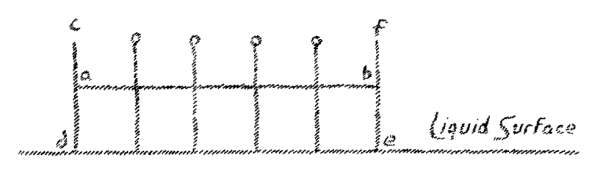
We can say, whatever form a solid may have, it falls along a line perpendicular to the surface of the earth. When now, we draw the perpendicular to these parallel lines of fall, we obtain a surface parallel to the earth's surface (line a-b, Fig. 3). By drawing all possible perpendiculars, to the lines of fall, we will obtain a complete surface parallel to the earth's surface. This is at first an imagined surface. We may now ask the question, where in reality is this surface? It is actually present in fluid bodies. A liquid which I place in a vessel shows as a real liquid surface that which I have assumed here as produced by drawing perpendiculars to the line of fall (see c, d, e, f, in Fig. 3).
What is really involved here and what does it mean? What we are speaking of is a thing of tremendous import. For, imagine to yourselves the following: Suppose someone were trying to explain the liquid surface and stated it this way. Every minute portion of the liquid has the tendency to fall to the earth. Since the other portions hinder this, the liquid surface is formed. The forces are really there, and the presence of the liquid causes the surface to form.
Picture to ourselves the real condition of the bodies you are going to let fall, and nature herself will show you what you have said in this explanation, (Fig. 4). You must include the liquid surface in your thinking. I have said formerly: the liquid surface is to be thought of in its relation to solids at right angles to their line of fall. When you think this through to the end, you come upon the noteworthy thing that what you have to bring into the solid as something thought out, this is represented in a material way before you by liquid bodies. These incorporate, as it were, what is materially present in the liquid. We may say: bodies of lower degrees of aggregation, solids in their relation to the earth, show a picture of that which is really present in the liquid, in a material way, and which in the case of water present in the liquid, in a material way, and which in the case of water prevents the surface particles from falling into the liquid. This is pictured, as it were, in considering the solid in its relation to the whole earth.
Think what this enables us to do When I draw the line of fall and the surface formed under the pressure of a system of falling bodies, then I have a picture of the gravitational activity. This is a direct representation of matter in the liquid state.
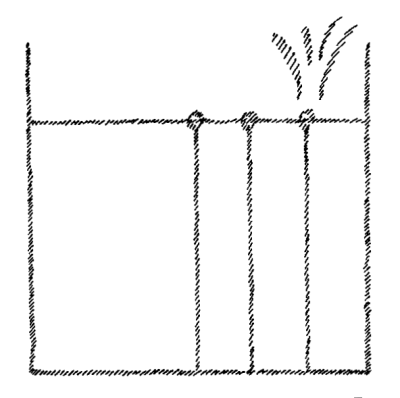
We can proceed further. When we leave water at any temperature sufficiently long it dries up. Water is always evaporating. The conditions under which it forms a liquid surface are only relative. It must be confined all around except on the liquid surface. It evaporates continuously, more rapidly in a vacuum. If we draw lines showing the direction in which the water is tending, their direction must indicate the movement of the water particles when it actually evaporates. When I actually draw these lines, however, I get nothing more or less than a representation of a gas that is enclosed all around and is striving to escape in every direction (Fig. 5). On the surface of water there is a certain tendency which, when I picture it for explanatory purposes, represents a gas set free and distributing itself in all directions. So again, we can state the proposition: that which we observe in water as a force is actually represented in a material way in a gas.
There is a curious fact brought out here. If we look at fluids correctly from a certain point of view, we discover in them a picture of the gaseous state of aggregation. When we picture solids properly, we discover in them a representation of the fluid state of aggregation. In every step as we go down there is a representation of the preceding step. Let us illustrate by going from below up. We can say, in the solids we have a representation of the fluid state, in the fluid a representation of the gaseous, in the gaseous a representation of heat. It is this that we have especially to deal with tomorrow. I will say only this today, that we have sought to find the bridge for thought from gases to heat. It will become clearer tomorrow. Now when we have followed further this path of thinking:
In solids the picture of the fluid state;
In fluids the picture of the gaseous state;
In gases the picture of the heat state;
Then we will have, indeed, taken a great step ahead. We have advanced to the point where we have a picture in the gaseous state which is accessible to human observation, of heat manifestations and even of the real nature of heat itself. The possibility then exists for us that by rightly seeking the representations of heat in the gaseous state, we can explain its nature even though we are obliged to admit that it is an unknown entity to us at the outset. But we must do this in a proper manner. When the various phenomena that we have described so far are handled as physics usually handles them, we get nowhere. But when we hold correctly in our minds those things that are revealed to us by bodies under the influence of heat and pressure, then we will see how we, actually in fact, come to stand before that which the gases can reveal to us—the real being of heat.
In cooling, where we deal with the liquid and solid states, the being of heat penetrates further. We have then to recognize in these states the nature of this entity, although we can do it best in the gaseous condition where it is more evident. We must see whether in the fluid and solid states, heat suffers a special change, and thus work out the distinction between the manifestation in the gas where it shows itself in pictures form and its manifestation in fluids and solids.
Sechster Vortrag
[ 1 ] Wir werden heute zunächst einige Erscheinungen anschauen, welche ‚aus dem Gebiet der Zusammengehörigkeit von Wärme, Druck und Ausdehnung der Körper sind. Denn Sie werden sehen, daß durch die zusammenschauenden Betrachtungen desjenigen, was wir erfahren können an solchen Erscheinungen, sich uns gerade der Weg eröffnen wird zum Verständnis dessen, was das Wärmewesen eigentlich ist. Wir werden zunächst einmal die Erscheinung betrachten, die sich hier ergibt durch den Inhalt dieser drei Röhren (siehe Zeichnung, 1, 2, 3). In der ersten Röhre rechts (1) haben wir eine Quecksilbersäule, wie man sie in einer Barometerröhre hat, und oben etwas Wasser. Wasser, welches in einer solchen Weise in einem Raum drinnen ist, verdunstet fortwährend. Wir haben das Wasser in dem sogenannten Vakuum, in dem leeren Raum, und wir können sagen, Wasser verdunstet. Die kleine Menge Wassers, die dadrinnen ist, verdunstet fortwährend. Wir können diese Verdunstung durch die Anwesenheit des Wasserdampfes, der drinnen ist, konstatieren: Wenn Sie vergleichen die Quecksilbersäule in ihrer Höhe, wie sie hier in dieser Röhre (1) ist, mit der Quecksilbersäule hier drinnen \((b)\), die unter dem normalen Luftdruck steht, über welcher also kein verdunstetes Wasser, also kein Wasserdampf ist, so werden Sie sehen, daß diese Quecksilbersäule (1) tiefer steht wie jene \((b)\). Diese Quecksilbersäule kann natürlich nur tiefer stehen als diejenige im Barometer, wenn ein Druck vorhanden ist, der oben ausgeübt wird, während hier oben \((b)\) kein Druck von irgend etwas vorhanden ist. Es ist ein leerer Raum, so daß diese Quecksilbersäule nur entgegensteht, als ihm das Gleichgewicht haltend, dem äußeren Atmosphärendruck. Hier (1) wird sie heruntergedrängt. Wenn wir abmessen, werden wir finden, daß wir hier \((b)\) von dieser Höhe ab eine höhere Quecksilbersäule haben. Um was sie hier (1) niedriger ist, wird durch den Druck, die sogenannte Spannkraft des darin befindlichen verdunstenden Wassers bewirkt, das heißt, es wird die Quecksilbersäule heruntergedrängt. Wir sehen also, daß Dampf immer auf die Wände drückt, und zwar wird ein bestimmter Druck unter einem bestimmten Wärmezustand ausgeübt. Das können wir dadurch konstatieren, daß wir den oberen Teil dieser Glasröhre erwärmen. Sie werden sehen, wenn die Temperatur höher wird, wird die Quecksilbersäule sinken, das heißt, der Druck wird größer werden. Wir werden also sehen, daß ein Dampf um so mehr auf die Wand drückt, je höher seine Temperatur ist. Sie sehen die Quecksilbersäule jetzt schon sinken, und sehen, wie die Spannkraft, die Druckkraft mit der Temperatur wächst. Das Volumen, das dann der Dampf einnehmen will, wird vergrößert.
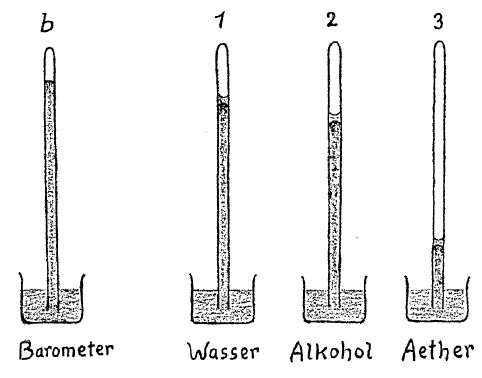
[ 2 ] In der zweiten Röhre (2) haben wir über dem Quecksilber Alkohol. Wiederum sehen Sie den Alkohol da drinnen einen gewissen Rauminhalt hindurch flüssig. Er verdunstet ebenfalls, daher ist auch diese Säule weniger hoch als die linke am Barometer. Wenn ich abmesse, werde ich aber auch finden, daß sie hier weniger hoch ist, als früher die Quecksilbersäule unter dem Einfluß des verdunsteten Wassers war. Wir müssen warten, bis hier (1) die Säule wiederum so hoch steigt, als
[ 3 ] na sie vor der Erwärmung war. Dann werden wir finden, daß die Spannung auch abhängt von der Substanz selber, die wir verwenden. Diese Spannung ist also größer bei Alkohol als bei Wasser. Auch hier (2) könnte ich wiederum erwärmen. Sie werden sehen, daß die Spannung wesentlich höher wird, wenn wir die Temperatur erhöhen. Wenn wir den Dampf soweit abkühlen, daß wir ihn wieder unter derselben Temperatur haben wie früher, dann steigt das Quecksilber, also bei geringerem Druck, geringerer Spannkraft. Sie sehen, die Säule steigt.
[ 4 ] In der dritten Röhre (3) haben wir unter sonst gleichen Verhältnissen Äther eingefüllt, der wiederum verdunstet. Sie sehen, die Säule ist hier sehr niedrig. Daraus ersehen Sie, daß, wenn wir Äther unter sonst gleichen Verhältnissen zum Verdunsten bringen, er wesentlich anders als verdunstendes Wasser drückt. Es hängt also der Druck, der auf die Umgebung von einem Gase ausgeübt wird, von der Temperatur ab, aber auch von der Substanz selber. Auch hier könnten Sie sehen, daß das Volumen, wenn wir erwärmen, wesentlich größer wird, daß der verdunstende Äther also wesentlich stärker drückt. Wir wollen auch hier wiederum die Erscheinungen festhalten, da wir gerade durch die Überschau über die Erscheinungen zu unserem Resultat kommen wollen.
[ 5 ] Nun, eine Erscheinung, die ich Ihnen besonders vorführen will, ist diese: Sie wissen aus den vorhergehenden Betrachtungen und auch, sonst aus der Elementarphysik, daß wir feste Körper in flüssige, flüssige in feste Körper überführen können, indem wir sie über den sogenannten Schmelzpunkt bringen nach oben oder unten. Nun, wenn ein flüssiger Körper wiederum fest wird, also unter den Schmelzpunkt heruntergebracht wird, so tritt er uns zunächst als fester Körper entgegen. Das Merkwürdige, und was wir wieder ins Auge zu fassen haben bei unserer Überschau, ist dieses, daß, wenn wir jetzt beim festen Körper einen stärkeren Druck anwenden, als derjenige war, unter dem er sich verfestigt hat, er wiederum flüssig werden kann. Also, er kann unter einer tieferen Temperatur wieder flüssig werden, als diejenige ist, bei der er zum festen Zustand übergeht. Sie wissen, bei 0° geht Wasser über in den festen Zustand, wird zu Eis. Es müßte also das Eis bei allen Temperaturgraden, die unterhalb Null liegen, ein fester Körper sein. Wir werden nun hier an diesem Eis ein Experiment machen, durch das Sie sehen werden, daß wir es flüssig machen können, ohne daß wir die Temperatur erhöhen. Würden wir es unter gewöhnlichen Verhältnissen flüssig machen wollen, so würden wir die Temperatur erhöhen müssen, aber wir werden die Temperatur nicht erhöhen, sondern wir werden auf das Eis einen mächtigen Druck ausüben. Diesen Druck üben wir dadurch aus, daß wir dieses Gewicht anhängen. Es wird hier das Eis zerschmelzen. Sie werden also sehen, daß das Eis hier durchgeschnitten wird, weil es sich unter dem von dem Drahte ausgeübten Druck verflüssigt. Sie werden nun erwarten, daß, indem dieser Eisblock durch den Druck zu Wasser wird in der Mitte, nun links und rechts die beiden Eisstücke herunterfallen. Wenn wir schneller machen würden, würden wir das Experiment gelingen sehen. (Das Zerschneiden des Eisblockes geht so langsam vor sich, daß erst am Ende der Stunde darüber folgendes hinzugefügt wird:) Wenn Sie jetzt hierhertreten, werden Sie sehen, daß, wenn Sie auch warten würden, bis der Schnitt richtig durchgeführt ist, Sie doch nicht zu fürchten hätten, daß zwei Eisstücke herunterplumpsen würden. Es wird sofort wiederum über dem Draht das Eis zusammenwachsen, und der Draht geht ganz durch, fällt unten durch, und der Eisblock bleibt ganz. Sie sehen daraus, daß da, wo der Druck ausgeübt wird durch Vermittlung des Drahtes, Flüssigkeit entsteht. Aber in dem Augenblick, wo der Druck nicht mehr ausgeübt wird, hat sich darüber die Flüssigkeit sogleich wiederum zum Eis verfestigt, das heißt, es wächst wiederum zusammen. Diese Verflüssiigung des Eises durch den Draht hält eben nur an — wenn die Temperatur dieselbe bleibt — unter dem Einflusse des betreffenden Druckes. Man kann also auch einen festen Körper unterhalb seines Schmelzpunktes zurückverflüssigen. Er braucht aber dann die Fortdauer dieses Druckes, um flüssig zu bleiben. Hört der Druck auf, dann tritt wiederum der feste Zustand ein. Das ist das, was Ihnen entgegengetreten sein würde, wenn Sie hier noch einige Stunden warten würden.
[ 6 ] Das dritte, was wir uns vor Augen führen wollen und was eine weitere Stütze sein wird für unsere Betrachtungen, das ist das Folgende: Wir könnten irgendwelche geeignete Körper nehmen, denn im Prinzip gilt es eigentlich für alles, was wir betrachten wollen, für alle diejenigen Körper, die miteinander eine Legierung eingehen, das heißt, sich so verbinden können, daß sie sich durchdringen, ohne chemische Verbindung zu werden. Wir haben hier in einem Probiergläschen Blei. Blei ist nun ein Körper, der bei 327 °C schmilzt, also übergeht aus dem festen in den flüssigen Zustand. In einem anderen Probiergläschen haben wir Wismut, das bei 269 °C schmilzt, und hier haben wir Zinn, das bei 232 °C schmilzt. Wir haben also drei Körper, welche alle Schmelzpunkte haben über 200 °C. Wir werden nun diese drei Körper, indem wir sie zuerst schmelzen, also in flüssigen Zustand überführen, miteinander zu einer Legierung verbinden, so daß sie dann durcheinandergehen, ohne eine chemische Verbindung zu werden. (Die drei Metalle werden einzeln geschmolzen und dann zusammengegossen.) Sie werden nun sich leicht denken können: Wenn wir irgendeines dieser drei Metalle, die ja durchaus einen Schmelzpunkt über 200 °C haben, einfach in kochendes Wasser hineintun, so bleibt es fest, denn das Wasser hat nur einen Schmelzpunkt von 0° und einen Siedepunkt von 100°, es kann also keines dieser drei Metalle in diesem Wasser zum Schmelzen kommen. Nun werden wir aber den Versuch machen, in eben siedendes Wasser die Legierung, die Ineinanderfügung der drei Metalle hineinzubringen, also in Wasser von 100°C. Schon jetzt kann konstatiert werden, was da eigentlich zugrunde liegt. Wir halten das Thermometer herein in die Legierung der drei Metalle und stellen fest in dem noch flüssigen Metallgemisch drinnen eine Temperatur von 175°. Sie sehen daraus: Keines der einzelnen Metalle würde bei dieser Temperatur noch flüssig sein, jedes wäre schon fest. Die Legierung der drei Metalle ist noch flüssig. So daß wir schon daraus sagen können: Wenn wir Metalle durcheinandermischen, so kann die Erscheinung eintreten, daß der Schmelzpunkt, der Punkt, bei dem das Metallgemisch flüssig wird, tiefer ist als der Schmelzpunkt eines jeden der einzelnen Metalle. Sie sehen also, wie sich Körper gegenseitig beeinflussen. Und wir werden gerade aus dieser Erscheinung eine wichtige Grundlage zu schöpfen haben in unserer Überschau über die Wärmeerscheinungen.
[ 7 ] Nun geben wir die noch flüssige Metallegierung bei 100° glatt hinein in das siedende Wasser, das also ebenfalls 100° hat. Und jetzt lassen wir das Wasser auskühlen. Beobachten wir nun die Temperatur. Es ist die Metallegierung drinnen noch flüssig, sie wird dann fest werden. Das heißt, wir kommen zum Schmelzpunkt herunter, und wir können dann, indem das Wasser unter den Siedepunkt geht, konstatieren an dem Punkt der Temperatur, auf dem das Wasser angekommen ist, wann die Metallegierung fest wird, also wo sie ihren Schmelzpunkt hat. Sie sehen also: Der Schmelzpunkt des Metallgemisches ist tiefer als der Schmelzpunkt jedes einzelnen Metalles.
[ 8 ] Nun, wir haben diese Erscheinungen wiederum zu den anderen hinzugefügt, um eben eine weiter ausgebreitete Grundlage für die Überschau zu haben, und wir können jetzt noch einige Betrachtungen anknüpfen an dasjenige, was wir uns schon gestern vor Augen geführt haben über den Unterschied des festen, des flüssigen, des gas- oder dampfförmigen Zustandes. Sie wissen, daß feste Körper, namentlich eine größere Anzahl von Metallen und andere mineralische Körper, nun nicht in unbestimmter Gestalt, sondern in ganz bestimmten Gestalten, in sogenannten Kristallen, auftreten. So daß wir sagen können: Unter den gewöhnlichen Verhältnissen, unter denen wir auf der Erde leben, treten uns die festen Körper in Kristallform, also in ganz bestimmten Gestaltungen entgegen. Das muß natürlich darauf aufmerksam machen, nachzudenken darüber, wie solche Kristallgestaltungen entstehen, welche Kräfte bei diesen Kristallgestaltungen zugrunde liegen. Wir müssen nun, um Vorstellungen über diese Dinge zu gewinnen, darauf sehen, wie sich nun etwa die ganze Summe von auf der Erdoberfläche befindlichen und nicht mit der Erdenmasse direkt zusammenhängenden festen Körpern verhalten. Sie wissen, wenn wir einen festen Körper irgendwo in der Hand halten und lassen ihn los, so fällt er zur Erde. Man deutet das in der Physik gewöhnlich so, daß man sagt: Die Erde zieht diese festen Körper an, sie übt eine Kraft aus. Unter dem Einfluß dieser Kraft, der Schwerkraft oder Gravitation, fällt der Körper zur Erde.
[ 9 ] Wenn wir irgendeinen flüssigen Körper haben und ihn dann abkühlen, so wird er uns, wenn er fest wird, auch auftreten können in bestimmten Kristallgestalten. Die Frage wird nun entstehen: Wie ist überhaupt das Verhältnis derjenigen Kraft, welcher alle festen Körper zunächst unterliegen, der Schwerkraft, zu den Kräften, welche ja doch auch da sein müssen, und auf eine bestimmte Art bewirken müssen, daß sich feste Körper in kristallinischen Gestalten ausleben? Sie können sich leicht denken, die Schwerkraft als solche, durch die ein Körper zur Erde fällt - wenn wir überhaupt von einer solchen Schwerkraft reden wollen zunächst -, sie kann es nicht sein, die zu gleicher Zeit mit der Bildung der Kristallformen etwas zu tun hat. Denn dieser Schwerkraft unterliegen alle Kristallformen; wie ein Körper äußerlich auch gestaltet sein mag, er folgt dieser Schwerkraft. Wir finden, wenn wir eine Anzahl von festen Körpern so behandeln, daß wir ihnen ihre Unterlage entziehen, daß sie alle in parallelen Linien zur Erde fallen. Wir können dieses Fallen etwa in der folgenden Weise darstellen. Wir können sagen: Welche Gestalt auch immer irgendwelche feste Körper haben, sie fallen zur Erde in der Richtung einer Senkrechten auf die Erdoberfläche. Wenn wir nun andererseits wiederum die Senkrechte ziehen auf diese zueinander parallelen Linien, bekommen wir eine zur Erdoberfläche parallele Fläche. Wir können alle möglichen senkrechten Schwerlinien, die wir durch irgendwelche Körper bekommen, so behandeln, daß wir eine gemeinsame, zur Erdoberfläche parallele, auf diese Schwerlinien senkrechte Fläche ziehen. Diese Fläche ist zunächst eine gedachte. Wir fragen uns: Wo ist diese Fläche wirklich? Sie ist bei flüssigen Körpern wirklich. Eine Flüssigkeit, die ich nehme, die ich in ein Gefäß gebe, bei der kann ich sehen, wie das, was ich sonst als eine Senkrechte auf die einzelne Schwerlinie ziehe, als Flüssigkeitsniveau wirklich vorhanden ist.
[ 10 ] Wie ist denn das eigentlich, was bedeutet das denn eigentlich? Dieses, was wir jetzt zusammengestellt haben, ist etwas ungeheuer Schwerwiegendes. Denn denken Sie sich einmal das Folgende: Es würde jemand sagen, wie um Ihnen zu erklären, wie es sich verhält mit der Niveaufläche der Flüssigkeit: Da ist ein Gefäß, da drinnen habe ich eine Flüssigkeit, die bildet eine Niveaufläche. Jedes Teilchen der Flüssigkeit hat das Bestreben, zur Erde hinzufallen. Dadurch, daß die Kräfte in der Flüssigkeit selber verhindern, daß die Teilchen zur Erde hinfallen, dadurch wird die Niveaufläche gebildet. Die ist da wirklich vorhanden. Die Flüssigkeit macht, daß das entsteht.
[ 11 ] Denken Sie, wenn Sie nun die Anfangslage von festen Körpern nehmen, die Sie fallen lassen, so zeichnet Ihnen die Natur selber das hin, was Sie hier behufs dieser Erklärung hingezeichnet haben. Und Sie müssen sich die Niveaufläche dazudenken. Ich sagte daher früher: Bei festen Körpern ist die Niveaufläche zunächst gedacht als die Senkrechte auf die Schwerlinie. Wenn Sie diesen Gedanken durchdenken, finden Sie das Merkwürdige, daß dasjenige, was Sie sonst machen, um Gedanken hineinzubringen in die Flüssigkeit, das macht eine Anzahl von festen Körpern vor Ihnen. Die zeichnen Ihnen gewissermaßen das auf, was in der Flüssigkeit materiell da ist. Wir können sagen: Der Körper von niedrigerem Aggregatzustand, der feste Körper in seinem Verhalten auf der Erdoberfläche, der verrät uns wie im Bilde dasjenige, was eigentlich bei der Flüssigkeit da ist, was bei der Flüssigkeit materiell ist, das die Verwirklichung dieser Linie als Fallinie verhindert. Das wird bildlich, wenn ich den festen Körper in seinem ganzen Verhältnis zur Erde betrachte.
[ 12 ] Denken Sie, was ich dadurch kann. Dadurch würde ich, wenn ich mir aufzeichne die Schwerlinien und die Niveaufläche unter dem Eindruck des Fallens eines Systems von festen Körpern, dadurch würde ich ein Bild bekommen der Schwerkraftwirkung. Das würde direkt ein Bild sein der flüssigen Materie.
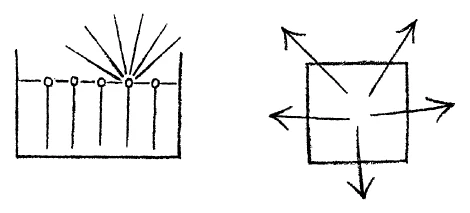
[ 13 ] Wir können weitergehen. Wenn wir bei irgendeiner Temperatur das Wasser nur genügend lang da (in einer Schale) drinnen lassen — deshalb sagte ich, die Dinge sind alle relativ —, so trocknet es aus. Irgendwie verdunstet das Wasser immer, das heißt, es ist eigentlich nur ein relativer Zustand vorhanden, bei dem wir sagen können: Das Wasser bildet eine Niveaufläche, es muß in seiner Form nur von den anderen Seiten gehalten werden, während es nach der einen Seite eine Niveaufläche bildet. — Es verdunstet fortwährend, im Vakuum also schneller. Deshalb können wir sagen: Wenn wir hier Linien zeichnen, nach denen das Wasser eigentlich fortwährend strebt, so müssen das Kraftlinien des Wassers sein, deren Richtung als Weg dann wirklich auch eingehalten wird, wenn das Wasser verdunstet. Wenn ich aber diese Linien, nach denen das Wasser strebt, einzeichne, bekomme ich nichts anderes als ein Bild eines Gases, das in einem allseitig geschlossenen Raum ist, und nach allen Seiten wirklich strebt, nach allen Seiten zerstiebt. An der Oberfläche des Wassers ist ein Streben danach, das, wenn ich es einzeichne, um das Streben zu erklären, ein Bild ist von dem, was wirklich vorgeht, wenn ich ein Gas freilasse, und es sich nach allen Seiten verbreitet. So daß ich wieder sagen kann: Dasjenige, was ich an der Flüssigkeit bemerke als Kraft, das ist mir ein Bild desjenigen, was beim Gas materielle Wirklichkeit ist.
[ 14 ] Wir haben eine kuriose Tatsache: Wenn wir in einer gewissen Weise richtig Flüssigkeiten betrachten, so nehmen wir wahr in diesen Flüssigkeiten Bilder des gasförmigen Zustandes. Wenn wir feste Körper richtig betrachten, nehmen wir wahr Bilder des flüssigen Zustandes. In jedem folgenden Zustand nach unten entstehen Bilder des vorhergehenden Zustandes. Dehnen wir das bis nach oben aus. Wir können sagen: Im festen Körper entdecken wir die Bilder des Flüssigen. Im flüssigen Körper entdecken wir die Bilder des Gasförmigen. Im gasförmigen Körper entdecken wir die Bilder der Wärme. Das wird dasjenige sein, was wir insbesondere morgen näher durchzuführen haben werden. Aber ich will noch das sagen: Wir haben versucht, heute den Gedankenübergang zu finden von den Gasen zur Wärme. Es wird morgen schon noch klarer werden. Und wenn wir diesen Gedankenweg weiter verfolgen werden:
im Festen die Bilder des Flüssigen
im Flüssigen die Bilder des Gasförmigen
im Gasförmigen die Bilder der Wärme
[ 15 ] dann haben wir ja einen wichtigen Schritt gemacht. Wir haben die Möglichkeit gewonnen, an den Bildern, die sich uns an dem Gaszustande ergeben werden, in dem menschlichen Beobachtungsfelde Offenbarungen der Wärme, und zwar des wirklichen Wärmewesens, dann zu haben. Wir gewinnen die Möglichkeit, das, wovon wir jetzt immer sagen mußten, daß es ein zunächst Unbekanntes ist, dadurch aufzuklären, daß wir in der richtigen Weise seine Bilder im gasförmigen Zustand suchen. Wir müssen die Bilder des Wärmewesens bei den Körpern des gasförmigen Zustandes suchen, Allerdings, wir müssen das richtig tun. Wenn man einfach den Umfang der Erscheinungen, den wir schon beobachtet haben, so beschreibt, wie es die gegenwärtige Physik gewohnt ist, wenn man so von den Gasen redet, kommt man zu nichts. Aber wenn man richtig ins Auge faßt dasjenige, was sich uns für die Körper unter dem Einfluß von Druck und Temperatur ergeben hat, dann werden wir sehen, wie wir tatsächlich vor dem Ergebnis stehen werden, daß uns zunächst das Gasige verrät, was eigentlich das Wärmewesen ist.
[ 16 ] Nun wirkt aber das Wärmewesen weiter beim Erkalten in flüssige und feste Zustände hinein. Und wir werden in die Notwendigkeit versetzt werden, nun zu verfolgen — am gasigen Zustand werden wir das am besten anschaulich sehen können -, was das Wärmewesen ist; am flüssigen und festen Zustand werden wir sehen müssen, ob das Wärmewesen eine besondere Veränderung für sich selbst erlebt, um dann durch diesen Unterschied, wie es sich offenbart im Gasförmigen, wo es uns seine Bilder zeigt, und im Flüssigen und Festen, auf das wirkliche Wesen der Wärme selbst zu kommen.
Sixth Lecture
[ 1 ] Today we will first look at some phenomena that arise from the interrelationship between heat, pressure, and the expansion of bodies. You will see that by looking at what we can learn from such phenomena, we will find our way to understanding what heat actually is. We will first consider the phenomenon that arises here from the contents of these three tubes (see drawing, 1, 2, 3). In the first tube on the right (1), we have a column of mercury, as found in a barometer tube, and some water at the top. Water contained in a space in this way evaporates continuously. We have the water in what is known as a vacuum, in empty space, and we can say that water evaporates. The small amount of water that is inside evaporates continuously. We can observe this evaporation through the presence of water vapor inside: If you compare the height of the mercury column here in this tube (1) with the mercury column here inside \((b)\), which is under normal air pressure, above which there is no evaporated water, i.e., no water vapor, you will see that this mercury column (1) is lower than the one \((b)\). Of course, this mercury column can only be lower than the one in the barometer if there is pressure exerted from above, whereas here above \((b)\) there is no pressure from anything. It is an empty space, so that this mercury column only counteracts the external atmospheric pressure, keeping it in equilibrium. Here (1) it is pushed down. If we measure, we will find that here \((b)\) we have a higher mercury column from this height. The difference by which it is lower here (1) is caused by the pressure, the so-called tension force of the evaporating water inside it, that is, the mercury column is pushed down. So we see that steam always presses against the walls, and that a certain pressure is exerted under a certain heat condition. We can confirm this by heating the upper part of this glass tube. You will see that as the temperature rises, the mercury column will sink, that is, the pressure will increase. We will therefore see that the higher the temperature of the steam, the more it presses against the wall. You can already see the mercury column sinking and see how the tension and pressure increase with the temperature. The volume that the steam then wants to occupy is increased.

[ 2 ] In the second tube (2), we have alcohol above the mercury. Again, you can see that the alcohol inside is liquid throughout a certain volume. It also evaporates, which is why this column is also lower than the left one on the barometer. However, when I measure it, I will also find that it is lower here than the mercury column was before under the influence of the evaporated water. We have to wait until the column here (1) rises again to the same height as it was before heating.
[ 3 ] it was before heating. Then we will find that the tension also depends on the substance itself that we use. This tension is therefore greater with alcohol than with water. Here too (2) I could heat it again. You will see that the tension becomes significantly higher when we increase the temperature. If we cool the vapor to the same temperature as before, the mercury rises, i.e., at lower pressure, lower tension. You can see that the column rises.
[ 4 ] In the third tube (3), we have filled it with ether under otherwise identical conditions, which in turn evaporates. You can see that the column is very low here. From this you can see that when we cause ether to evaporate under otherwise identical conditions, it exerts a significantly different pressure than evaporating water. The pressure exerted on the environment by a gas therefore depends on the temperature, but also on the substance itself. Here, too, you can see that the volume becomes significantly larger when we heat it, meaning that the evaporating ether exerts significantly more pressure. We want to record the phenomena here as well, since we want to arrive at our result by reviewing the phenomena.
[ 5 ] Now, one phenomenon that I would like to demonstrate to you in particular is this: you know from the previous considerations and also from elementary physics that we can transform solid bodies into liquid ones and liquid ones into solid ones by raising or lowering them above or below the so-called melting point. Now, when a liquid body becomes solid again, i.e., is brought below the melting point, it initially appears to us as a solid body. The remarkable thing, and what we must again take into account in our overview, is that if we now apply a stronger pressure to the solid body than the one under which it solidified, it can become liquid again. So, it can become liquid again at a lower temperature than the one at which it transitions to a solid state. You know that at 0°C, water transitions to a solid state and becomes ice. So ice should be a solid body at all temperatures below zero. We are now going to conduct an experiment with this ice, which will show you that we can make it liquid without raising the temperature. If we wanted to make it liquid under normal conditions, we would have to raise the temperature, but we are not going to raise the temperature; instead, we are going to exert powerful pressure on the ice. We exert this pressure by attaching this weight. The ice will melt here. You will see that the ice is being cut through here because it liquefies under the pressure exerted by the wire. You would now expect that, as this block of ice turns into water in the middle due to the pressure, the two pieces of ice on the left and right will fall down. If we were to do this more quickly, we would see the experiment succeed. (The cutting of the block of ice is so slow that the following is only added at the end of the lesson:) If you now step up here, you will see that even if you were to wait until the cut has been made properly, you would not have to fear that two pieces of ice would fall down. The ice will immediately grow back together above the wire, and the wire will pass right through, fall through at the bottom, and the ice block will remain intact. You can see from this that where pressure is exerted by the wire, liquid is formed. But the moment the pressure is no longer applied, the liquid immediately solidifies back into ice, that is, it grows back together. This liquefaction of the ice by the wire only lasts—if the temperature remains the same—under the influence of the pressure in question. It is therefore possible to liquefy a solid body below its melting point. However, it then needs the pressure to be maintained in order to remain liquid. If the pressure ceases, the solid state returns. This is what you would have encountered if you had waited a few more hours here.
[ 6 ] The third thing we want to consider, which will further support our observations, is the following: We could take any suitable substances, because in principle this applies to everything we want to consider, to all substances that form an alloy with each other, i.e., that can combine in such a way that they interpenetrate without forming a chemical compound. Here we have lead in a test tube. Lead is a substance that melts at 327 °C, i.e., it changes from a solid to a liquid state. In another test tube we have bismuth, which melts at 269 °C, and here we have tin, which melts at 232 °C. So we have three substances, all of which have melting points above 200 °C. We will now combine these three substances into an alloy by first melting them, i.e., converting them into a liquid state, so that they mix together without forming a chemical compound. (The three metals are melted individually and then poured together.) You can easily imagine that if we simply put any of these three metals, which have a melting point above 200 °C, into boiling water, they will remain solid, because water has a melting point of only 0 °C and a boiling point of 100 °C, so none of these three metals can melt in this water. Now, however, we will attempt to place the alloy, the combination of the three metals, into boiling water, i.e., water at 100°C. We can already see what is actually happening here. We hold the thermometer in the alloy of the three metals and find that the temperature of the still liquid metal mixture inside is 175°C. You can see from this that none of the individual metals would still be liquid at this temperature; each would already be solid. The alloy of the three metals is still liquid. So we can already say from this that When we mix metals together, the melting point, the point at which the metal mixture becomes liquid, can be lower than the melting point of each of the individual metals. So you can see how bodies influence each other. And it is precisely from this phenomenon that we will have to draw an important basis for our overview of thermal phenomena.
[ 7 ] Now we pour the metal alloy, which is still liquid at 100°, smoothly into the boiling water, which also has a temperature of 100°. And now we let the water cool down. Let's observe the temperature. The metal alloy is still liquid inside, but it will then solidify. This means that we are approaching the melting point, and we can then, as the water falls below the boiling point, determine at the temperature at which the water has arrived when the metal alloy will solidify, i.e., where its melting point is. So you see: the melting point of the metal mixture is lower than the melting point of each individual metal.
[ 8 ] Now, we have added these phenomena to the others in order to have a broader basis for our overview, and we can now add a few more observations to what we already discussed yesterday about the difference between the solid, liquid, gaseous, and vaporous states. You know that solid bodies, namely a large number of metals and other mineral bodies, do not occur in indefinite forms, but in very specific forms, in so-called crystals. So we can say that under the normal conditions in which we live on earth, solid bodies appear to us in crystal form, that is, in very specific configurations. This naturally draws our attention to the question of how such crystal formations arise and what forces underlie them. In order to gain mental images of these things, we must now look at how the entire sum of solid bodies located on the Earth's surface and not directly connected to the Earth's mass behaves. You know that when we hold a solid body in our hand and let it go, it falls to the ground. In physics, this is usually interpreted by saying that the earth attracts these solid bodies, that it exerts a force. Under the influence of this force, gravity, the body falls to the ground.
[ 9 ] If we have any liquid body and then cool it, it will, when it becomes solid, also be able to appear in certain crystal forms. The question now arises: What is the relationship between the force to which all solid bodies are initially subject, gravity, and the forces that must also be present and must in some way cause solid bodies to take on crystalline forms? You can easily imagine that gravity as such, by which a body falls to the earth – if we want to talk about such a force of gravity at all – cannot be the force that has something to do with the formation of crystal shapes. For all crystal shapes are subject to this force of gravity; no matter what the external shape of a body may be, it follows this force of gravity. We find that when we treat a number of solid bodies in such a way that we remove their support, they all fall in parallel lines to the earth. We can represent this falling in the following way. We can say: whatever shape any solid bodies may have, they fall to the earth in the direction of a perpendicular to the earth's surface. If, on the other hand, we draw the perpendicular to these parallel lines, we obtain a plane parallel to the Earth's surface. We can treat all possible perpendicular lines of gravity that we obtain through any bodies in such a way that we draw a common plane parallel to the Earth's surface and perpendicular to these lines of gravity. This plane is initially an imaginary one. We ask ourselves: Where is this surface really? It is real in the case of liquid bodies. If I take a liquid and pour it into a vessel, I can see how what I would otherwise draw as a perpendicular line to the individual lines of gravity actually exists as the liquid level.

[ 10 ] What does this actually mean? What we have now put together is something tremendously serious. Just think about the following: Someone would say, to explain to you how the level surface of the liquid works: There is a vessel, and inside it I have a liquid that forms a level surface. Every particle of the liquid tends to fall toward the earth. The forces in the liquid itself prevent the particles from falling toward the earth, thus forming the level surface. It really exists. The liquid causes it to arise.
[ 11 ] Consider the initial position of solid bodies that you drop. Nature itself draws for you what you have drawn here for the purpose of this explanation. And you must add the level surface to your imagination. I therefore said earlier: In the case of solid bodies, the level surface is initially thought of as the perpendicular to the line of gravity. If you think this through, you will find it remarkable that what you otherwise do to bring thoughts into the liquid is done by a number of solid bodies in front of you. They draw for you, as it were, what is materially present in the liquid. We can say: the body of a lower state of aggregation, the solid body in its behavior on the earth's surface, reveals to us, as in a picture, what is actually present in the liquid, what is material in the liquid, which prevents the realization of this line as a fall line. This becomes pictorial when I consider the solid body in its entire relationship to the earth.
[ 12 ] Think what I can do with this. By recording the lines of gravity and the level surface under the impression of a system of solid bodies falling, I would obtain a picture of the effect of gravity. This would be a direct picture of liquid matter.

[ 13 ] We can go further. If we leave the water in there (in a bowl) long enough at any temperature—that's why I said things are all relative—it dries out. Somehow, the water always evaporates, which means that there is actually only a relative state in which we can say: The water forms a level surface; its shape only has to be held in place by the other sides, while it forms a level surface on one side. — It evaporates continuously, faster in a vacuum. Therefore, we can say: If we draw lines here, which the water actually strives to follow continuously, then these must be lines of force of the water, whose direction is then actually maintained as a path when the water evaporates. But when I draw these lines, which the water strives to follow, I get nothing more than an image of a gas that is in a space closed on all sides and really strives in all directions, dispersing in all directions. On the surface of the water, there is a striving that, when I draw it in to explain the striving, is an image of what really happens when I release a gas and it spreads in all directions. So that I can say again: what I perceive as force in the liquid is, for me, an image of what is material reality in the gas.
[ 14 ] We have a curious fact: when we look at liquids in a certain way, we perceive images of the gaseous state in these liquids. When we look at solid bodies in the right way, we perceive images of the liquid state. In each subsequent state downwards, images of the previous state arise. Let us extend this upwards. We can say: in solid bodies we discover images of the liquid state. In liquid bodies we discover images of the gaseous state. In gaseous bodies we discover images of heat. This will be what we will have to examine more closely tomorrow in particular. But I would like to add this: Today we have tried to find the transition of thought from gases to heat. It will become even clearer tomorrow. And if we continue to follow this line of thought:
in the solid, the images of the liquid
in the liquid, the images of the gaseous
in the gaseous, the images of heat
[ 15 ] then we will have taken an important step. We will have gained the opportunity to see in the images that will arise for us in the gaseous state, in the human field of observation, revelations of heat, and indeed of the real nature of heat. We gain the opportunity to clarify what we have always had to say is initially unknown by searching for its images in the gaseous state in the right way. We must seek the images of the nature of heat in bodies in the gaseous state, but we must do so correctly. If we simply describe the scope of the phenomena we have already observed in the way that contemporary physics is accustomed to doing, if we talk about gases in this way, we will get nowhere. But if we correctly consider what we have observed in bodies under the influence of pressure and temperature, we will see that we actually arrive at the conclusion that it is the gaseous state that first reveals to us what the heat entity actually is.
[ 16 ] Now, however, the thermal entity continues to act as it cools into liquid and solid states. And we will be compelled to pursue—we will be able to see this most clearly in the gaseous state—what the thermal entity is; in the liquid and solid states, we will have to see whether the heat entity undergoes a special change in itself, in order to then arrive at the real essence of heat itself through this difference, as it reveals itself in the gaseous state, where it shows us its images, and in the liquid and solid states.

